头版头条
市政府批复同意上海张江高新技术产业开发区空间调整
8月13日,上海市政府发布同意上海张江高新技术产业开发区空间调整方案的相关文件。文件指出同意新设张江高新区自贸保税园,作为市级高新技术产业园区,纳入张江高新区管理范围,重点发展软件和信息服务业、高技术制造业和现代服务业;同意将张江高新区原静安园和原闸北园合并为新的张江高新区静安园。张江高新区各分园在上海科创办的指导下,将聚焦集成电路、人工智能、生物医药三大产业,加快培育世界级产业集群。(上海市政府)
浦东新区支持创新成果产业化——生物医药专项资助申报通知发布
8月13日,浦东新区科技和经济委员会发布了2020年度浦东新区促进重点优势产业高质量发展,支持创新成果产业化—生物医药专项资助申报工作的若干政策措施。政策对在2019年1月1日至2019年12月31日期间,企业开展创新药物开发、上市给予支持。网上申报的受理时间为2020年8月17日10时至2020年8月28日16时。(浦东科经委)
浦东新区鼓励产业链协同联动——生物医药专项资助申报通知发布
8月13日,浦东新区科技和经济委员会发布了2020年度浦东新区促进重点优势产业高质量发展,鼓励产业链协同联动—生物医药专项资助申报工作的若干政策措施。政策鼓励企业开展药品上市许可持有人制度和医疗器械注册人制度试点。网上申报的受理时间为2020年8月17日10时至2020年8月28日16时。(浦东科经委)
企业信息
赫普化治疗NASH创新药HPN-01获NMPA临床试验许可
8月14日,上海赫普化医药技术有限公司宣布,公司自主研发的1类创新药HPN-01肠溶胶囊近日顺利获得国家药品监督管理局的临床试验许可,目标适应症是非酒精性脂肪性肝炎,这是赫普化继今年2月份获得美国FDA的临床试验许可后的又一里程碑。HPN-01这一基于全新靶点研究的创新药物有望突破目前全球NASH及肝纤维化没有一线治疗药物可用的现状。(赫普化医药)
康希诺生物正式在科创板上市
8月13日,康希诺生物正式在上海证券交易所科创板上市。根据招股说明书,该公司本次公开发行的股票数量为2480万股,每股发行价格为209.71元,募集资金约52亿元,募集资金中约10亿元将用于新型疫苗产能扩大与新疫苗产品研发等项目。本次康希诺生物在科创板上市意味着首个“A+H”疫苗股正式诞生。(康希诺生物)
德琪医药ATG-017即将于澳大利亚开展全球首次临床试验
8月13日,德琪医药宣布,公司已收到澳大利亚药品管理局的确认,同意ERK1/2的高特异性小分子抑制剂ATG-017进行治疗晚期实体瘤及血液瘤患者的临床试验。临床前研究表明,ATG-017可以通过靶向ERK1/2调节多个细胞进程,并有效抑制体外肿瘤细胞株的活性与体内肿瘤的生长。这是德琪医药成立以来获得的首个TGA临床许可,标志着ATG-017即将开展全球首次临床试验。(德琪医药)
捍宇医疗完成新一轮5亿人民币融资
近日,上海捍宇医疗科技有限公司宣布,完成新一轮5亿人民币融资。本轮融资由弘晖资本、CPE及盈科资本联合领投,筹集的资金将用于推动公司领先产品Valve Clamp 的上市,以及新产品的持续研发。Vavel Clamp是我国自主研发的首个进入上市前临床实验的二尖瓣微创介入治疗器械,已申请国际PCT专利。目前正处于上市前临床阶段,并有望成为继雅培后第二个在国内上市二尖瓣修复器械。(捍宇医疗)
上科大王皞鹏学者等开发新型CAR-T疗法
近日,上海科技大学王皞鹏课题组联合中科院分子细胞科学卓越创新中心许琛琦实验室、复旦大学附属眼耳鼻喉科医院吴海涛课题组,在 Immunity 杂志上以封面文章的形式发表了题为“具有持久抗肿瘤效果的新型可循环嵌合型抗原受体”的研究论文。该研究提出了一种新型的“可循环CAR”设计方案,显著地提高了CAR-T细胞在体内的持续活性和抗肿瘤效果,为防止CAR-T治疗后的肿瘤复发提供了新策略。(生物制品圈)
艾康特完成近亿A轮融资
近日,艾康特完成近亿元A轮融资,并已锁定A+轮融资。本轮融资由红杉资本中国领投,夏尔巴投资,复星创富、松禾资本、元生创投、横琴金投等共同投资。本轮融资资金将主要用于加速推进艾康特多款眼视光医疗器械产品的研发、临床与注册进程。艾康特将推出角膜接触镜和国内首款巩膜镜产品,其中巩膜镜将会填补国内行业空白。(艾康特)
复宏汉霖贝伐珠单抗HLX04完成3期临床试验
近日,复宏汉霖宣布已完成贝伐珠单抗生物类似药HLX04用于转移性结直肠癌治疗的3期临床研究,试验的主要终点和次要终点均已达到。研究结果表明,HLX04用于一线治疗转移性结直肠癌的疗效与原研药等效,其安全性、耐受性及免疫原性与原研药相似。基于已取得的研究结果,复宏汉霖计划于近期就HLX04治疗转移性结直肠癌、非鳞状非小细胞肺癌适应症向国家药品监督管理局递交上市注册申请。(复宏汉霖)
景峰医药子公司获医疗器械生产行政许可
8月12日,景峰医药公布,旗下全资子公司上海景峰制药有限公司于近日收到《上海市药品监督管理局准予行政许可决定书》。医用透明质酸钠凝胶的生产范围为Ⅲ类16-07眼科植入物及辅助器械,有效期至2025年08月10日。该品系透明质酸钠制成的高浓度凝胶,为生物可降解性高分子聚糖类生物材料,无菌、无致畸及致炎性,具有良好的生物相容性及生物学活性。(景峰医药)
Perceptive Advisors携手多个战略联盟创立联拓生物
8月12日,联拓生物宣布正式成立。它是由Perceptive Advisors创立、培育和孵化的公司,其产品管线包括来自Myokardia、BridgeBio子公司Navire Pharma和QED Therapeutics的多种潜在突破性治疗产品,并且与BridgeBio Pharma达成战略伙伴关系,让联拓生物可以优先获得其超过20多种管线产品。联拓生物的目标是推动药物研发并加快颠覆性药物在中国和亚洲其他主要市场的上市流通。(联拓生物)
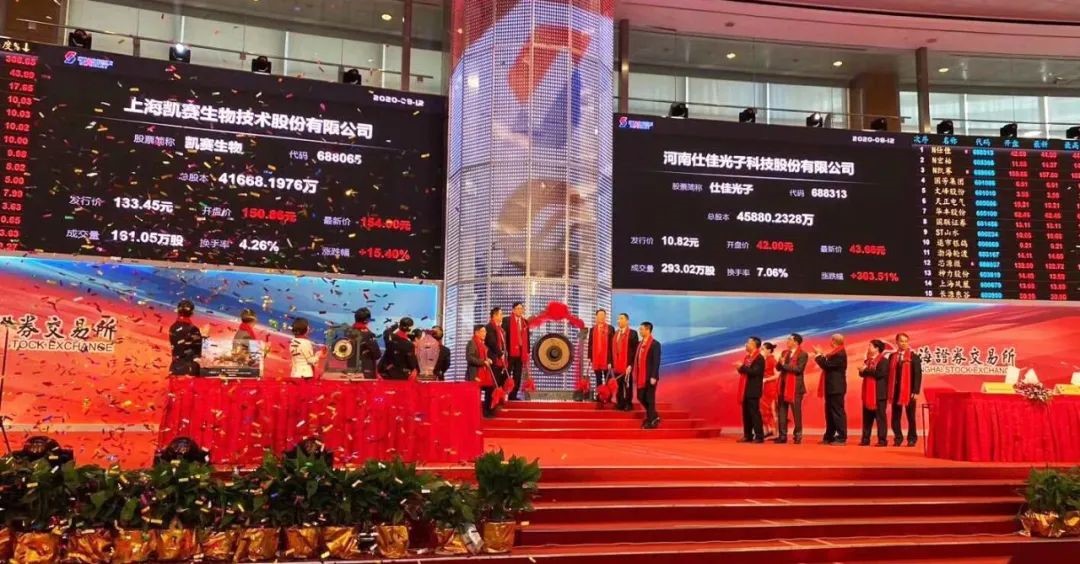
凯赛生物科创板发行上市
8月12日,上海凯赛生物技术股份有限公司成功在上海证券交易所科创板挂牌上市,其发行价格为133.45元每股,开盘价为150.86元每股,发行数量为4166.82万股。截至收盘,凯赛生物报收157元每股,总市值681亿元。凯赛生物的发行上市,标志着“我国合成生物产业化第一股”正式诞生。(凯赛生物)
沃比医疗完成数亿元B+轮融资
8月11日,上海沃比医疗科技有限公司宣布完成数亿元人民币的B+轮融资,本轮融资由中信医疗基金领投,现有投资机构股东麦星投资,前海母基金和长安私人资本追加投资。融资主要用于促进其全球出血和缺血性卒中治疗产品组合的开发,加快在欧美、日本、南美等海外市场布局,支持公司正在进行的两项临床试验,推进2021年出血和缺血性卒中产品在国内取证及上市。(沃比医疗)
赞荣医药完成2000万美元A+轮融资
近日,小分子肿瘤创新药企业赞荣医药科技有限公司宣布完成近2000万美元的A+轮融资。本轮融资由夏尔巴投资和启明创投共同领投,幂方资本跟投。融资所得主要用于推进公司旗下核心项目在中美两地开展临床一期试验,推进其余项目完成IND申报和临床候选药的筛选。此外公司还将募集到的资金用于新项目的开发,完成公司研发管线多元化和临床国际化的布局。(赞荣医药)
糖尿病视网膜病变眼底图像辅助诊断软件产品获批上市
近日,国家药品监督管理局经审查,批准了上海鹰瞳医疗科技有限公司生产的创新产品“糖尿病视网膜病变眼底图像辅助诊断软件”注册。该产品适用于对成年糖尿病患者的双眼免散瞳彩色眼底图像进行分析,为执业医师提供是否发现中度非增殖性(含)以上糖尿病性视网膜病变以及进一步就医检查的辅助诊断建议。(鹰瞳医疗)
风湿免疫领域创新药恩瑞舒成功上市
8月9日,先声药业与百时美施贵宝在中国大陆合作开发的自身免疫系统创新药恩瑞舒在上海举行上市会,这也标志着恩瑞舒在中国大陆地区正式进入商业流通环节。恩瑞舒作为全球类风湿关节炎领域第一个被批准的T细胞选择的共刺激免疫调节剂,在中国大陆的全面上市,将为600万类风湿性关节炎患者带来新的选择。(先声药业)
璧辰医药完成两千万美元A+轮融资
近日,璧辰医药宣布完成两千万美元A+轮融资。本轮融资由华创资本领投,国药资本、磐霖资本、聚明创投跟投。现有股东凯泰资本、LongDAC继续参投。融资将用于加速推进璧辰医药ABM-1310的临床研究和现有多个临床前项目的开发,进一步丰富研发管线,在可突破血脑屏障的小分子研发方面创造可持续的价值。(璧辰医药)
仁度生物助力上海移动式核酸检测方舱实验室交付
8月7日,上海应急科技攻关项目“上海移动式核酸检测方舱实验室”在浦东国际机场正式交付,该实验室采用了上海仁度生物科技有限公司研发的AutoSAT全自动核酸检测分析系统,是国内首个符合国家海关《移动式加强型生物安全二级实验室技术要求》、具有标准集装箱尺寸的P2+级别移动式核酸检测实验室。实验室可支持在浦东机场开展随到随检,满足上海海关至少500份/天的检测需求,与送至市区实验室相比,可节约2小时的等待时间。(仁度生物)
政策快递
2020年第二季度上海市医疗器械不良事件监测情况发布
8月12日,上海药监局发布了2020年第二季度上海市医疗器械不良事件监测情况。报告显示,在今年第二季度上海市个例不良事件报告中,涉及最多的为III类医疗器械产品,共1121份,占56.1%;其次为II类产品,共705份,占35.2%;最后为I类产品,共174份,占8.7%。不良事件报告数列前五位的产品类别分别是:注输、护理和防护器械、无源手术器械、无源植入器械、物理治疗器械和有源植入器械。(上海药监局)
《治疗脂代谢紊乱药物临床试验技术指导原则(征求意见稿)》发布
8月10日,国家药监局发布《治疗脂代谢紊乱药物临床试验技术指导原则(征求意见稿)》。低密度脂蛋白胆固醇升高是动脉粥样硬化性心血管疾病重要的危险因素。近年来,治疗脂代谢紊乱的新药开发进展迅速,此次意见稿旨在进一步明确技术标准,提高企业研发效率。征求意见时限为自发布之日起1个月。(国家药监局)